(Información transmitida por la empresa firmante)
–Encuesta de toda la industria revela que la regulación centralizada es la prioridad número uno de Medtech
La creciente necesidad de visibilidad y velocidad impulsa la adopción de sistemas regulatorios digitales
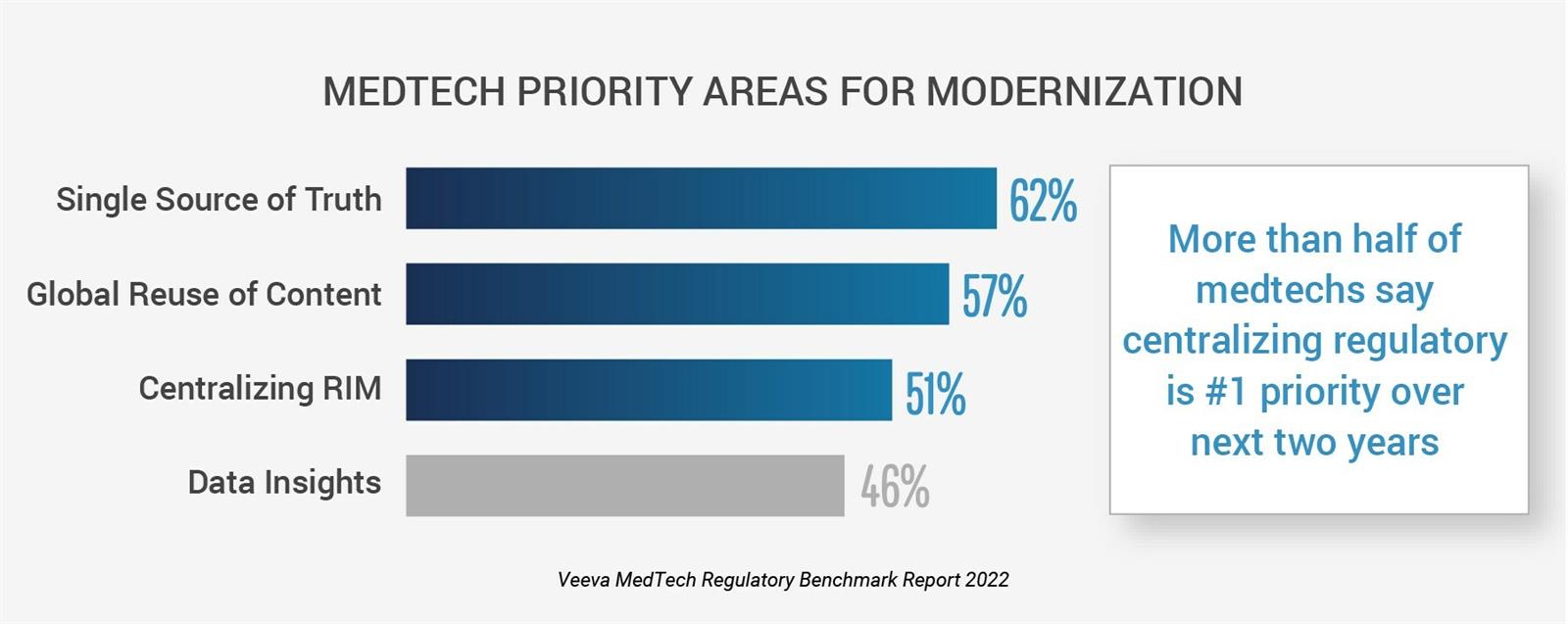
BARCELONA, España, 1 de marzo de 2023 /PRNewswire/ — Una nueva investigación muestra que la mayoría de las organizaciones de tecnología médica están tomando medidas para avanzar en cuestiones regulatorias, según el segundo informe anual de referencia regulatoria de Veeva MedTech. Más de la mitad de las empresas de tecnología médica afirman que establecer una fuente única de información reglamentaria (62 %) e implementar un sistema de gestión de información reglamentaria (RIM) global y centralizado (51 %) será el enfoque principal de la industria en los próximos dos años. Con la modernización en curso de la gestión de la información reglamentaria, los líderes de la industria están uniendo datos, contenido y sistemas para mejorar la información y el tiempo de comercialización.
Los datos revelan un mayor enfoque en los sistemas digitales para armonizar las operaciones a nivel mundial, con dos de cada cinco empresas que ya han elegido la tecnología de control digital. Este cambio a los sistemas digitales de RIM destaca la necesidad de una mayor transparencia y colaboración entre los equipos regionales para cumplir con los requisitos regulatorios y de gestión de cambios en evolución.
El informe revela desarrollos positivos en asuntos regulatorios y oportunidades de mejora, que incluyen:
Persisten los procesos manuales: solo el 13% de las empresas han implementado un sistema RIM digital global para la gestión integral de las operaciones regulatorias. Muchas organizaciones de tecnología médica se basan en procesos manuales, fuentes de datos desconectadas y sistemas aislados que no escalan, lo que dificulta la expansión a nuevos mercados.
Fuente única de datos de registro en aumento: las empresas que recopilan datos de registro global en un solo sistema han aumentado año tras año, lo que subraya la urgencia de establecer una fuente única de información regulatoria.
Los procesos de cumplimiento posteriores a la comercialización carecen de conexiones: la mayoría de las empresas (83 %) tienen integraciones de software, soluciones puntuales o procesos normativos y de calidad manuales para capturar los cambios posteriores a la comercialización dentro de la cartera de productos. La falta de un proceso de control de cambios transparente y automatizado aumenta el riesgo y puede generar problemas de cumplimiento o demoras.
“Con las nuevas regulaciones y la creciente complejidad de la cadena de suministro, las empresas de tecnología médica están evaluando caminos hacia procesos más transparentes para que los equipos puedan compartir datos de alta calidad”, dijo Seth Goldenberg, vicepresidente y presidente de Veeva MedTech. . “Esta investigación muestra que la industria de la tecnología médica está progresando mediante el avance de las operaciones regulatorias para una mejor visibilidad global, precisión de datos y cumplimiento”.
El informe Benchmark regulatorio de Veeva MedTech examina el progreso de la industria de diagnósticos y dispositivos médicos hacia la modernización de las operaciones regulatorias. Los encuestados incluyeron profesionales de asuntos regulatorios de más de 100 organizaciones de tecnología médica en todo el mundo, desde empresas hasta medianas empresas. Vea el estudio anual completo que explora cómo las empresas de tecnología médica gestionan la visibilidad y el cumplimiento global, la velocidad de comercialización, el cumplimiento posterior al mercado y la modernización.
Acerca de los sistemas Veeva
Veeva (NYSE: VEEV) es el líder mundial en software en la nube para la industria de las ciencias de la vida. Comprometida con la innovación, la excelencia del producto y el éxito del cliente, Veeva atiende a más de 1000 clientes, desde las compañías farmacéuticas más grandes del mundo hasta las compañías biotecnológicas emergentes. Como empresa de beneficio público, Veeva se compromete a equilibrar los intereses de todas las partes interesadas, incluidos los clientes, empleados, accionistas y las industrias a las que sirve. Para obtener más información, visite veeva.com/eu.
Foto: https://mma.prnewswire.com/media/2011266/Veeva_Systems_Regulatory_Benchmark_Report_charts_Modernization_Priorities.jpg
Logo-
Mostrar contenido original: